Şekil 1 İzotermal sıkıştırmada, sisteme yapılan iş üzerinden moleküllere verilen enerji, ısıl enerji olarak çevreye atılacağı için, moleküllerin sıcaklıkları ve dolayısıyla kinetik enerjileri artmayacak; sıkıştırma kolaylaşacak, belirli bir P2/P1 oranı için verilmesi gereken iş miktarı azalacaktır.
İçten tersinebilir ve adyabatik sıkıştırmada moleküllerin kazandıkları kinetik enerji ile T2, P2 makro durumuna karşı gelen mikro durum sayısının artıp artmadığını sorgulamıştık. Hâl değişiminin içten tersinebilir ve adyabatik olması nedeniyle, moleküllerin kinetik enerjilerinde, iç enerjilerinden kaynaklanan artışın düzgün dağılımlı ve uyumlu olacağı, bu nedenle entropinin sabit kalacağı sonucuna varmıştık.
MOLEKÜLLERİN KİNETİK ENERJİLERİ ARTMADI AMA... İçten tersinebilir ve izotermal hâl değişiminde ise moleküllerin kinetik enerjilerinde bir değişim yok ama bu değişimin olmasını engelleyen ısı geçişi nedeni ile dıştan tersinemezlik olma olasılığı söz konusu. Dıştan tersinemezlik, ısı geçişi nedeni ile oluşur. Ne zaman? Isı geçişi sonlu sıcaklık farkı altında gerçekleştiği zaman. Örneğin; sistem sıcaklığı T2=T1=T ve ısının atıldığı kuyu sıcaklığı T0 ise; hâl değişimi boyunca dıştan tersinemezlik söz konusudur.
İçten tersinenebilir her hangi bir hâl değişiminde, sistemin entropisindeki değişim; ısı geçişi miktarının, ısı geçişinin olduğu sistem sınırının mutlak sıcaklığına oranı kullanılarak hesaplanır:
 (5) (5)
Burada; kavramsal olarak üzerinde durulması gereken nokta; yapılan tanımın aslında yalnızca sistem ile ilgili olmadığı, hâl değişimi sırasındaki entropideki değişimin "tüm"ünü ilgilendirdiğidir. Şöyle ki; içten tersinemezliğin (sürtünme, âni genişleme, karışma vd.) olmadığı bir hâl değişiminde dıştan tersinemezlikler varsa, 'tüm' entropi, artabilir. Dıştan tersinemezlikler yoksa, sistemin ısı alışverişi yaptığı çevrenin entropisindeki değişim; sistemin entropisindeki değişimle sayısal olarak eşit, fakat zıt yönlü olur. Dıştan tersinemezliklerin olmaması, sistemin ısı geçişinin gerçekleştiği sınırı ile çevrenin aynı sıcaklıkta olması; bir başka anlatımla ısı geçişinin sonsuz küçük sıcaklık farkında olması demektir. Bu durumda, hâl değişimi dıştan da tersinebilirdir. (Anımsarsanız; Carnot, bu duruma 'kalori dengesi' demekteydi [2]. Gerçek olaylarda 'kalori dengesi' yoktur.)
KALORİ DENGESİZLİĞİ
Gerçek olaylarda, entropi değişimi; içten tersinebilir hâl değişimi sırasındaki ısı alışverişi miktarı ve bu ısı alışverişinin gerçekleştiği sistem sınırındaki sıcaklık değeri için
(7) şeklinde olacaktır. Bu anlatımla, yalnızca, "kalori dengesi"nin olduğu tümden tersinebilir (içten ve dıştan) hâl değişiminde, SGEN = 0 geçerlidir.
Peki; bu yazının konusu olan içten tersinebilir hâl değişiminde (içten tersinebilir izotermal sıkıştırma) dS hangi yöndedir? Sistem ısı attığına göre entropisi azalacaktır. Hâl değişimi içten tersinebilir olduğu için bu azalma; atılan ısının sistem sınırındaki sıcaklık değerine (hâl değişiminin izotermal olması sıcaklığın tüm değişim boyunca sabit kaldığı demek ama aynı zamanda sürekli akışlı bir sistem söz konusu olduğu için sistemin içinde konuma bağlı bir değişim de yok, aslında) oranına eşit olacaktır. Bu ısı çevreye atılmaktadır. Çevre ile sistem arasında sonsuz küçük sıcaklık farkı var ise çevrenin entropisindeki artış, sistemin entropisindeki azalma ile aynı olacaktır. (Bkz. aşağıdaki (10) bağıntısı).
Sistemdeki entropi azalmasının hangi koşullarda çevrenin entropisindeki artışa eşit olacağını irdelemeden önce sorulacak soru şu: Sistemin entropisi azaldığına göre moleküllerin kinetik enerjileri mi azaldı? Fakat; sıcaklık sabit kalmıştı. Entropiyi azaltan ne olabilir?
Yanıt çok yalın: Sıkıştırma nedeniyle, hacim küçüldü ve aynı sayıdaki molekülün küçülen hacim içerisinde sahip olabileceği "mikro durum sayısı" azaldı (Şekil 2). Isı geçişine izin verilmemiş olsa idi (Bkz. içten tersinebilir ve adyabatik sıkıştırma); mikro durum sayısı hacmin azalması ile azalsa da, sıcaklığın artması ile kinetik enerji artacak ve küçük hacimdeki mikro durum sayısı, sıkıştırmadan önceki geniş hacim - düşük kinetik enerji koşullarına göre daha yüksek olacaktı. İçten tersinir izotermal sıkıştırmada ise böyle bir durum söz konusu değil. Moleküllerin kinetik enerjileri artmazken, sığdıkları hacim azalıyor ve sonunda P2 , T2 makro durumuna karşı gelen mikro durumların sayısı azalıyor.
Şekil 2 Kinetik enerjileri değişmeyen (T2 =T1 ) moleküllerin artan basınç altında mikro durum sayıları azalacaktır.
Basıncın entropi üzerindeki etkisi, mükemmel gazlar için aşağıdaki denklemde de görülmektedir: 
(8) İzotermal sıkıştırmada sağ taraftaki birinci terim düşecek; P2 > P1 olduğu için ikinci terim pozitif, dolayısıyla;
(9) olacaktır (Şekil 3). İçten tersinemezlikler olmadığı için, sistemin entropisindeki bu azalma, (5) bağıntısına göre sistemin ısı alışverişinin, bu ısı alışverişininin gerçekleştiği sınırdaki mutlak sıcaklığına oranına eşit olacaktır.
Şekil 3 İçten tersinebilir izentropik sıkıştırmada sistemin entropisi azalacaktır.
ÇEVREYE NE OLDU? İşte, çevrenin entropisine ne olduğu tam bu noktada, sorulabilir. Çevre ile sistem arasındaki ısı alışverişi sonsuz küçük sıcaklık farkında ise
(10)
olacaktır. Bu durumda, (7) denklemi
(11) şeklini alacaktır. Burada hâl değişimi içten tersinebilir olduğu, dıştan tersinemezliklerin bulunmadığı kabülü yapılmıştır. Carnot'ya göre, 'kalori dengesi' sağlanmıştır!
Hâl değişiminin içten tersinebilir olmasına karşın, dıştan tersinebilirliğin söz konusu olmaması, sistem ile çevre arasındaki ısı geçişinin sonlu sıcaklık farkında gerçekleşmesi demektir. İzotermal sıkıştırmada sistemden ısı atıldığına göre çevrenin sıcaklığı; sonlu sıcaklık farkından söz ediliyorsa (gerçekte, ısı geçişi için 'sonlu sıcaklık farkı' gereklidir), sistemin sıcaklığından düşük olmalıdır. Bu durumda:
(13) geçerlidir. Diğer bir deyişle, (14) ZAMANA BIRAKMAK...O ZAMAN, YAVAŞLAMALI MI? Şu hâlde, şu soruyu sormakta fayda var: Dıştan tersinebilirliğin sağlanabileceği bir ısı alışverişini gerçekleştirmek olanaksız olsa da, bu ideal duruma yaklaşılarak içten tersinebilir bir izentropik sıkıştırmada SGEN en aza indirgenebilir mi?
Yanıt; tümüyle bir ısı geçişi uygulaması ile ilgili, aslında. Sistemin sıcaklığı T, çevrenin sıcaklığı T0 ise (sistemden ısı çekildiğine göre T0 < T olmalı), (12) bağıntısının 2 tarafı arasındaki farkın azalması ile SGEN azalacaktır.
Öte yandan; (T - T0 ) azaldıkça, aynı miktarda ısı geçişinin sağlanabilmesi için, ısı geçişi yüzeylerinin genişletilmesi gerekecektir. Bunun nedeni; sistemdeki ve çevredeki akışkanlar ile (kompresördeki sıkıştırma için sıkıştırılan gaz ve ısıyı çeken akışkan) ısı geçişinin olduğu yüzeyle aralarındaki etkileşime (taşınım), yüzey yapısı içinde olan ısı geçişine (iletim), dahası, yüzeylerin sıcaklıkları nedeni ile yaydıkları ve yuttukları ışınların neden oldukları ısı alışverişine (ışınım) karşı gelişen dirençtir. Bu direnç (R) ısı geçişinin hızını etkiler:
(15)
Bu durumda yapılması gereken, ısı geçiş alanı (A) artırılmaksızın, sınırlandırılmış SGEN değeri kısıtına uygun (T - T0 ) sıcaklık farkı koşulunda, birim zamandaki ısı geçişini (Q/t) azaltmaktır.
Sistemin sıcaklığını sabit tutmak için, sistemden çekilecek ısı miktarı gereken değerde olmalıdır. Isı geçişi miktarı azaltılamaz. O hâlde, ısı çekme işlemini yavaşlatarak (t'yi artırarak) (15) bağıntısında verilen denge sağlanabilir. Çünkü; zaman sonludur. Bir kez daha görüyoruz ki; kontrollü moleküler etkileşimleri ve toplam entropinin olabilecek en az şekilde değişmesini sağlarken, sıkıştırmanın ne kadar hızlı ve ne kadar az iş ile gerçekleştirilebileceğini değerlendirmek, ancak, sonlu zaman termodinamiği ile olanaklıdır.
MÜHENDİSİN ZAMANI KADEMELİ Mİ? (15) bağıntısı kullanılarak gerçekleştirilecek hâl değişimi, mühendislik açısından uygulanabilir olmayan (çok uzun) bir zaman dilimi gerektireceğinden, kompresör soğutmasında kademeli sıkıştırma kullanılarak T = sabit koşuluna yaklaşılır.
Her bir kademe; izentropik bir sıkıştırma (uygulamada n = k değildir, 1 < n< k şeklindedir, sonra tartışılacak) ve sabit basınçta soğutmadan oluşmaktadır (Şekil 4). Bu durumda, içten tersinebilir sıkıştırma için her bir kademedeki SGEN aşağıdaki şekilde hesaplanır:
Sistemin entropi değişimi
(16) olmak üzere (Şekil 4),
(17) (  : sıkıştırılan gazın kütlesel debisi.)
Şekil 4 Kademeli izotermal sıkıştırmada ((j-1)--j) kompresör kademesi.((j-1)--j'): izentropik,
j'--j: sabit basınçta soğutma) |















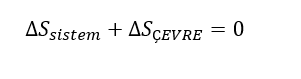










Yorumlar
Yorum Gönder